分類
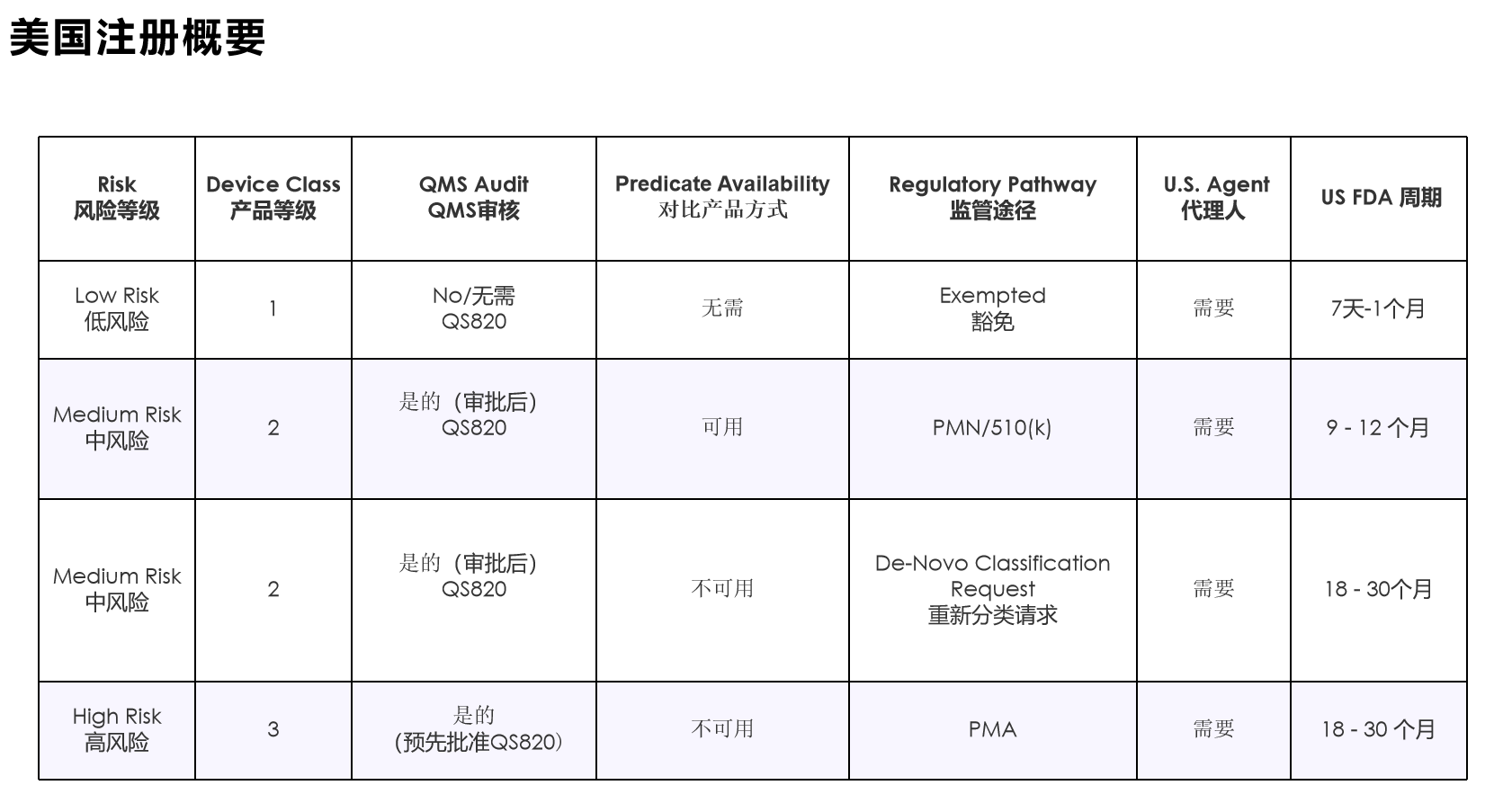
醫(yī)療器械分為一類����、二類、三類�����。
設(shè)備分類法規(guī)定義了一般設(shè)備類型的法規(guī)要求�。大多數(shù) I 類設(shè)備不受上市前通知 510(k) 的約束;大多數(shù) II 類設(shè)備需要上市前通知 510(k)�;大多數(shù) III 類設(shè)備需要上市前批準(zhǔn)。設(shè)備分類的描述和產(chǎn)品分類數(shù)據(jù)庫(kù)的鏈接可在“醫(yī)療設(shè)備分類”中找到����。
在美國(guó)銷售的醫(yī)療器械制造商必須遵守的基本監(jiān)管要求是:
· 公司注冊(cè)、
· 醫(yī)療器械產(chǎn)品列名��,
· 上市前通知 510(k)���,除非獲得豁免�,或上市前批準(zhǔn)(PMA)����,
· 臨床研究的研究設(shè)備豁免 (IDE)
· 質(zhì)量體系(QS)監(jiān)管�,
· 標(biāo)簽要求���,以及
· 醫(yī)療器械報(bào)告
合規(guī)流程
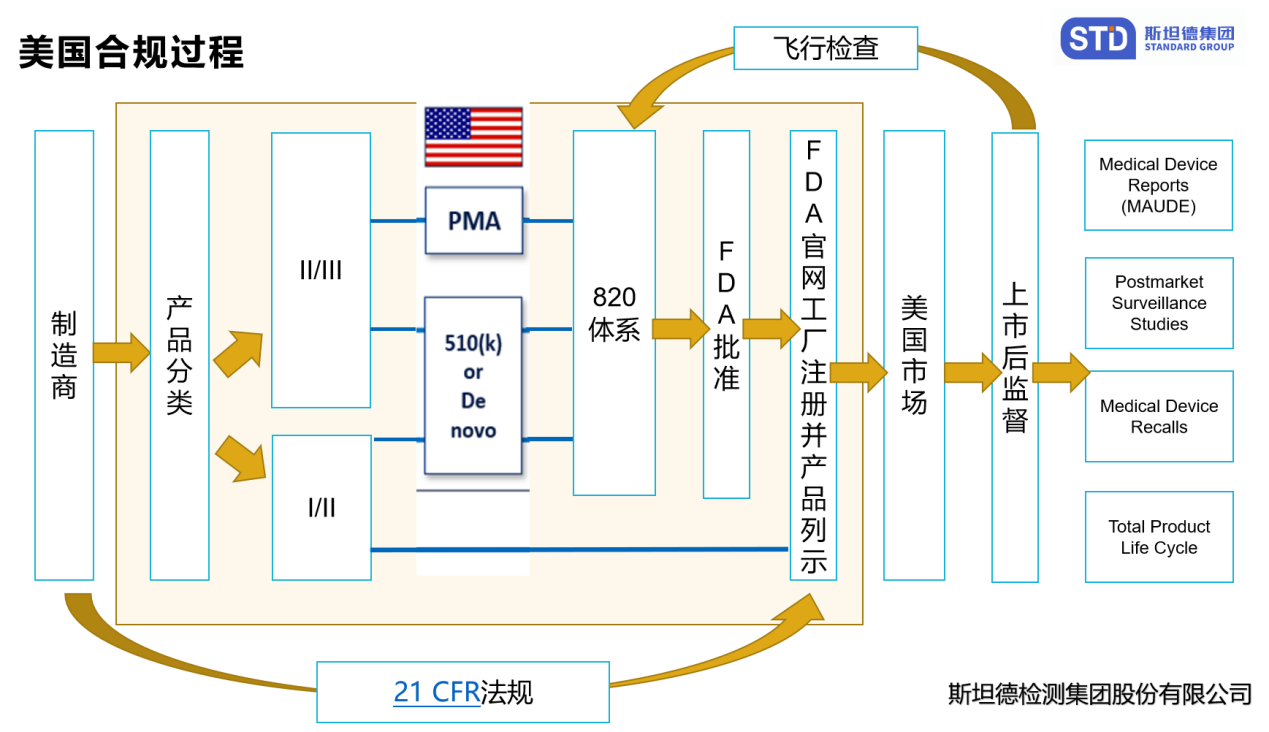
公司注冊(cè) - 21 CFR 第 807 部分
醫(yī)療器械制造商(國(guó)內(nèi)外)和初始分銷商(進(jìn)口商)必須向 FDA 注冊(cè)其機(jī)構(gòu)���。除非 FDA 授予豁免,否則所有企業(yè)注冊(cè)都必須以電子方式提交�����。除注冊(cè)外����,外國(guó)制造商還必須指定美國(guó)代理人。自 2007 年 10 月 1 日起����,大多數(shù)企業(yè)都需要繳納企業(yè)注冊(cè)費(fèi)。
醫(yī)療器械產(chǎn)品列明 - 21CFR 第 807 部分
制造商必須向 FDA 列出其設(shè)備��。需要列出其設(shè)備的機(jī)構(gòu)包括:
· 制造商,
· 合同制造商�,
· 合同滅菌器���,
· 重新包裝商和重新貼標(biāo)簽商��,
· 規(guī)范開(kāi)發(fā)人員����,
· 洗消一次性設(shè)備,
· 再制造商
· 直接銷售給最終用戶的配件和組件制造商
· “僅限出口”設(shè)備的美國(guó)制造商
上市前通知 510(k) - 21 CFR 第 807 部分 E 子部分
如果您的設(shè)備需要提交上市前通知 510(k)�,則在您收到 FDA 授權(quán)您這樣做的實(shí)質(zhì)等效信函之前,您不能對(duì)該設(shè)備進(jìn)行商業(yè)分銷���。510(k) 必須證明該設(shè)備與在美國(guó)合法商業(yè)銷售的設(shè)備實(shí)質(zhì)上等效:
2002 年 10 月 26 日����,《2002 年醫(yī)療器械使用費(fèi)和現(xiàn)代化法案》成為法律����。它授權(quán) FDA 對(duì)醫(yī)療器械上市前通知 510(k) 審查收取費(fèi)用。小企業(yè)可以支付較低的費(fèi)用����。申請(qǐng)費(fèi)適用于傳統(tǒng)、簡(jiǎn)化和特殊 510(k)�。上市前審查費(fèi)的支付與 FDA 對(duì)提交的最終決定沒(méi)有任何關(guān)系。
大多數(shù) I 類設(shè)備和一些 II 類設(shè)備無(wú)需提交上市前通知 510(k)�。
如果您計(jì)劃向 FDA 發(fā)送 I 類或 II 類設(shè)備的 510(k) 申請(qǐng)�,您可能會(huì)發(fā)現(xiàn)由認(rèn)可的機(jī)構(gòu)進(jìn)行的 510(k) 審查是有益的。FDA 授權(quán) 12 家組織對(duì) 670 種器械進(jìn)行初步審查。根據(jù)法律規(guī)定,F(xiàn)DA 必須在收到認(rèn)可人士的建議后 30 天內(nèi)做出最終決定。請(qǐng)注意�,由認(rèn)可人士進(jìn)行的 510(k) 審查免收任何 FDA 費(fèi)用;但是�,第三方可能會(huì)收取審核費(fèi)用。
上市前批準(zhǔn) (PMA) - 21 CFR 第 814 部分
需要 PMA 的產(chǎn)品屬于 III 類設(shè)備�,屬于高風(fēng)險(xiǎn)設(shè)備�,會(huì)帶來(lái)重大疾病或傷害風(fēng)險(xiǎn),或者通過(guò) 510(k) 流程發(fā)現(xiàn)與 I 類和 II 類謂詞實(shí)質(zhì)上不等同的設(shè)備�����。PMA 流程更為復(fù)雜���,包括提交臨床數(shù)據(jù)以支持設(shè)備的索賠����。
從 2003 財(cái)政年度開(kāi)始(2002 年 10 月 1 日至 2003 年 9 月 30 日),醫(yī)療器械使用費(fèi)適用于原始 PMA 和某些類型的 PMA 補(bǔ)充劑���。小型企業(yè)有資格享受減免或減免費(fèi)用���。
研究設(shè)備豁免 (IDE) - 21CFR 第 812 部分
研究器械豁免 (IDE) 允許在臨床研究中使用研究器械,以收集支持上市前批準(zhǔn) (PMA) 申請(qǐng)或向 FDA 提交上市前通知 510(k) 所需的安全性和有效性數(shù)據(jù)���。使用具有重大風(fēng)險(xiǎn)的設(shè)備進(jìn)行的臨床研究必須獲得 FDA 和機(jī)構(gòu)審查委員會(huì) (IRB) 的批準(zhǔn)才能開(kāi)始研究����。使用風(fēng)險(xiǎn)不重大的設(shè)備進(jìn)行的研究必須在研究開(kāi)始前獲得 IRB 的批準(zhǔn)��。
質(zhì)量體系法規(guī)(QS 法規(guī))- 21 CFR 第 820 部分
質(zhì)量體系法規(guī)包括與醫(yī)療器械的設(shè)計(jì)���、采購(gòu)����、制造、包裝�����、標(biāo)簽�����、儲(chǔ)存、安裝和服務(wù)所使用的方法�����、設(shè)施和控制相關(guān)的要求���。生產(chǎn)設(shè)施接受 FDA 檢查��,以確保符合質(zhì)量體系管理要求�����。
標(biāo)簽 - 21 CFR 第 801 部分
標(biāo)簽包括設(shè)備上的標(biāo)簽以及設(shè)備隨附的描述性和信息性文獻(xiàn)����。
醫(yī)療器械報(bào)告 - 21 CFR 第 803 部分
設(shè)備可能導(dǎo)致或?qū)е滤劳龌驀?yán)重傷害的事件����,必須根據(jù)醫(yī)療設(shè)備報(bào)告計(jì)劃向 FDA 報(bào)告。此外�����,還必須報(bào)告某些故障�。MDR 法規(guī)是 FDA 和制造商識(shí)別和監(jiān)控涉及醫(yī)療器械的重大不良事件的機(jī)制����。監(jiān)管的目標(biāo)是及時(shí)發(fā)現(xiàn)并糾正問(wèn)題���。
總結(jié)